Atom taneciklerinden elektronun yükü eksi, protonun yükü artıdır. Bir atomun nötr olabilmesi için + ve – yüklerin birbirine eşit olması gerekir.
Elektrik konusunda bir cismin nötr olabilmesi için + ve – yüklerin eşit olması gerektiğini öğrenmiştik.
Atomlar için de aynı durum geçerlidir.
Bir atomdaki + yüklü taneciklerin sayısı (yani protonlar), – yüklü taneciklere (yani elektronlara) eşitse bu atom nötr (yüksüz) demektir.
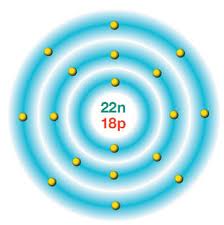
Yukarıda elektron dağılımı gösterilen atomu inceleyelim.
Çekirdekte proton sayısı 18 verilmiş.
Elektronlarını saydığımızda da 18 çıkıyor.
Bu atomun elektron ve proton sayısı eşit olduğu için NÖTR atomdur.
Bir atomun nötr olup olmadığını bulmak için toplama işlemi de kullanılabilir.
Protonlar + olduğu için +18
Elektronlar – olduğu için -18 yazarız.
Bu sayıları birbiriyle toplarız.
+18-18=0
SIFIR değerini bulabildiğimiz her atom nötr bir atomdur.
Başka bir atomu inceleyelim.
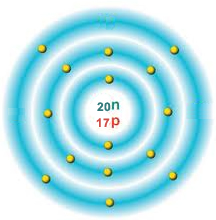
Bu atomun proton sayısı 17, yani +17
Elektron sayısı 15 yani, -15
+17-15= +2
Bu atom + 2 yüklüdür ve nötr değildir.
Katyon ve Anyon
Nötr olamayan atomlara İYON denir. İyonlardan + yüklülerine KATYON, – yüklülerine ANYON denir.
Ayrıntı için tıklayın >>
Kararlı Atom Nedir?
Bir atomun kararlı olabilmesi için katmanlarının tamamının elektronla dolu olması gerekir.
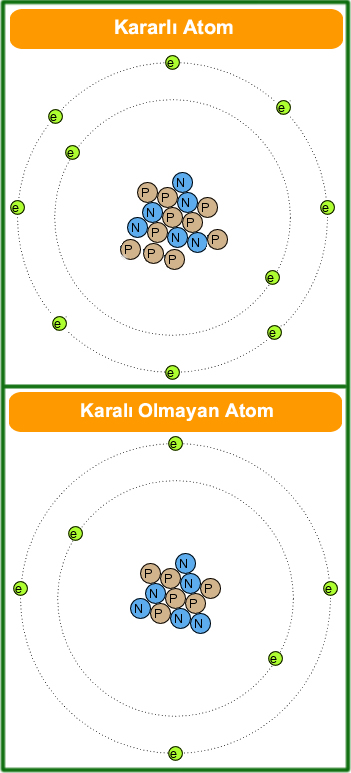
Yukarıdak, şekilde kararlı atoma bakarsak,
1. ve 2. katmanlar alabilecekleri tüm elektronları almış ve tam olarak dolmuştur. O halde KARARLIdır.
Kararlı olmayan atoma bakarsak,
1. katman en fazla 2 elektron alabilir dolu. 2. katman 8 elektron alabilir ama 4 tane var. Yani tam dolu değil. O halde KARARLI DEĞİL.
Elementlerden çoğu kararlı olmayan halde bulunur. Sürekli kararlı halde bulunan sadece 6 element bulunur. Bunlara soygazlar denir. Helyum, Neon, Argon, Kripton, Ksenon ve Radon son katmanları sürekli tam dolu olduğu için kararlı yapıdadır.
Atomlar Nasıl Kararlı Olur?
Son katmanı dolu olan atomların KARARLI olduğunu söylemiştik.
Tüm atomlar kararlı olmak ister. Yani elektron dizilimini soygazlara benzetmek ister. Bunun için elektron alır veya elektron verir.
Örneğin;
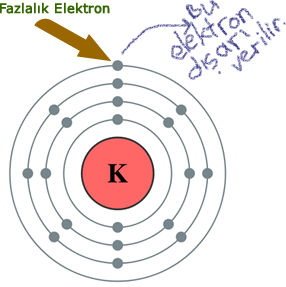
Yukarıdaki potasyum atomu kararlı değildir. Çünkü son katmanında sadece 1 elektronu vardır.
Bu atom ya 7 elektron alarak son katmanını 8 ‘e tamamlayacak, ya da 1 elektronunu vererek geriye 8 elektronlu 3. katmanı kalacak.
7 elektron almaktansa 1 elektron vermek daha kolay olduğu için atom bu elektronunu verir ve kararlı hale geçer.
Bu sayede +1 yüklü olur. Başka örnekler >>
Oktet Kuralı: Kararlı hale geçmek isteyen atomların son katmanını 8 elektrona tamamalamak istemesidir.
Dublet Kuralı: Kararlı hale geçmek isteyen atomların son katmanını 2 elektrona tamamlamak istemesidir. 1. katman en fazla 2 elektron aldığı için bazı atomlar için son katmanı 2’ye tamamlamak da kararlı hale geçmek için yeterlidir. Az sayıda elektronu bulunan Hidrojen, lityum, berilyum, bor elementleri bu kurala uyar.

Çok tessekürler sayenizde yarın ki sınavdan yüksek alıcam boyle devam edın çok iyı